治験の手続きについて
申請から治験開始までの流れ
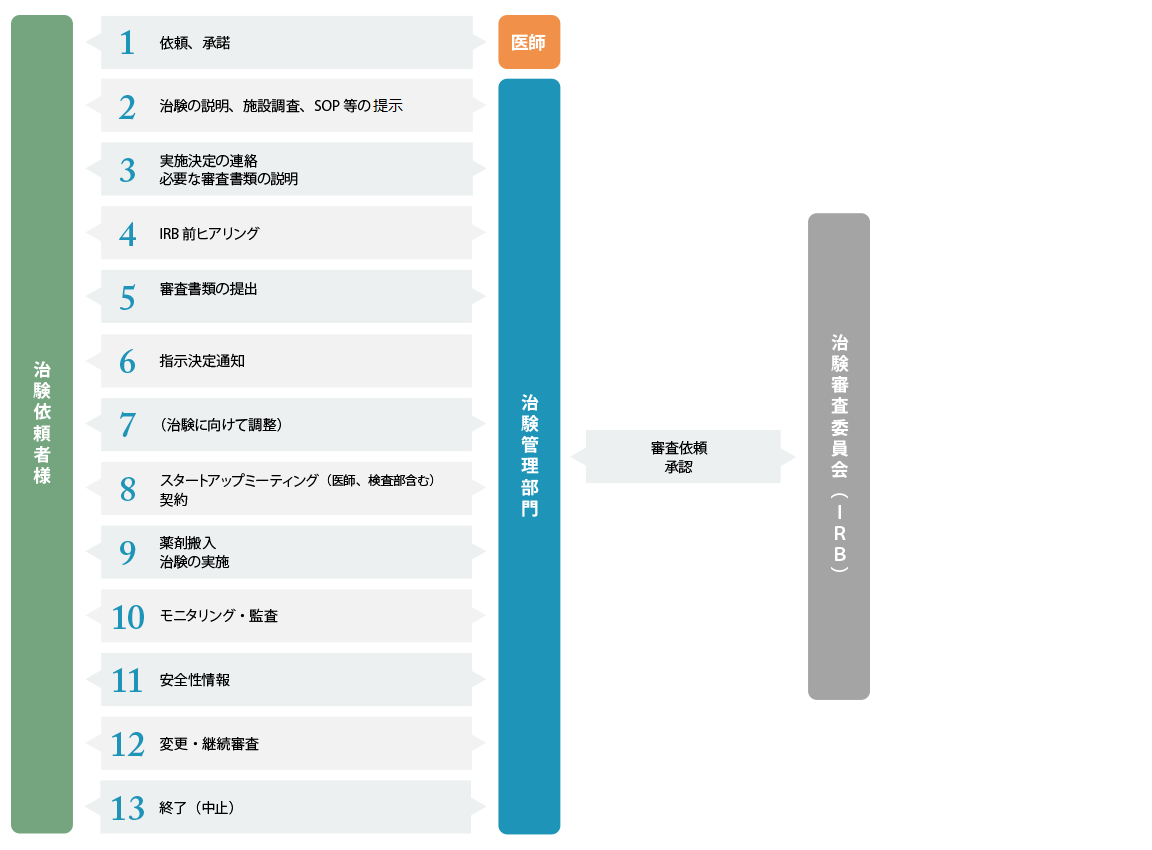
新規申し込み時の手続き
治験の依頼を検討されている場合は、治験事務局にご連絡をお願いいたします。
<連絡先>
臨床研究センター治験管理部門
TEL:073-441-0547 [月~金 9:00~17:00(土、日、祝日は休み)]
E-mail:chiken●wakayama-med.ac.jp
※●は@に置き換えてください。
施設調査
講座責任者及び治験責任医師候補者が実施について承諾した後、事前面談・施設調査の実施をお願いします。事前面談は原則web面談とし、治験事務局及びCRCが出席させていただきます。なお、治験事務局業務の一部をシミックヘルスケア・インスティテュート株式会社に委託しているため、原則施設調査から参加させていただきます。
また、調査票については、治験実施体制の情報を参考に作成をお願いします。
CRC業務については、SMOに委託することもあります。その場合は、別途必要な手続きが発生いたしますので、流れについてご説明させていただきます。
利益相反マネジメント委員会への手続き
治験審査委員会での審査前に本学における利益相反マネジメント委員会での審査が必要となります。「治験実施計画書(要約)」については、利益相反マネジメント委員会での審査に必要なため、治験審査委員会の前月18日までに必ずご提出をお願いいたします。
IRB提出資料
初回IRBの審査資料チェックリストに基づき、資料の準備をお願いします。
また、施設版の同意説明文書作成時は、同意説明文書作成時のチェックリストを基に作成をお願いします。
Agathaの利用申請
Agathaの利用に当たり、下記の資料が必要となります。治験事務局まで電子メールでご提出をお願いします。なお、1試験につき原則2名までの登録とさせていただきます。
・ユーザー情報登録シート
・モニター指名記録
・試験情報(統一書式3の添付資料一覧を除く情報)
また、モニター交代時は、提出済みのユーザー情報登録シートに後任者の情報と前任者の削除日を追記の上、モニター指名記録と合わせて治験事務局までご提出をお願いします。
ヒアリングの手続き
ヒアリングの日程は、IRB申請書類締切日の1か月前を目安に担当CRCと日程調整をお願いします。
ヒアリングに必要な資料等については、治験管理実施に必要な手続きをご確認ください。また、ヒアリングまでにヒアリングシートを作成の上、担当CRCに事前に送付をお願いします。
その他
担当窓口一覧
当院における担当窓口一覧は、こちらです。
Q&A
よくあるご質問や注意点について、こちらをご確認ください。
規程・手順書
様式一覧
| 様式番号 | 名称 | 作成者 | 受領者 |
|---|---|---|---|
| 別記第1号様式(その1) | 治験実施契約書(医薬品用) ※3者契約の場合は、本雛形に必要事項を追記してください。 |
依頼者 | 附属病院長 |
| 別記第1号様式(その2) | 治験実施契約書(医療機器用) | 依頼者 | 附属病院長 |
| 別記第1号様式(その3) | 治験実施契約書(再生医療等製品用) | 依頼者 | 附属病院長 |
| 別記第1号様式(その4) | 治験実施変更契約書 | 依頼者 | 附属病院長 |
| 別記第2号様式(その1) | 治験審査委託申出書 | 依頼者 | 附属病院長 |
| 別記第2号様式(その2) | 治験変更審査委託申出書 | 依頼者 | 附属病院長 |
| 様式A | 安全性情報等に関する見解 | 責任医師 | 附属病院長 |
| 様式I-2 | 直接閲覧結果報告書 | 依頼者 | 附属病院長 |
| 治験に係る経費積算表 | 依頼者 | 附属病院長 | |
| ※令和4年3月までに契約した治験については初回作成時の経費積算表を使用してください | |||
| 治験実施計画書(要約) | 依頼者 | 附属病院長 |