組織図
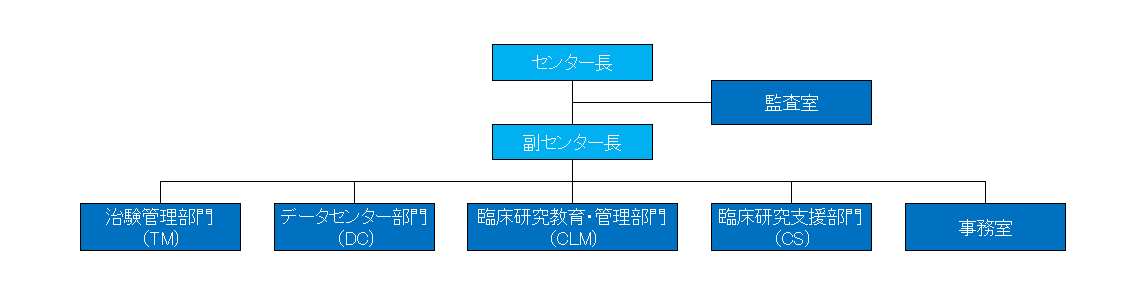
監査室
- 依頼があった臨床研究に対する監査の実施(監査計画書・監査報告書の作成を含む。)
- 病院長ガバナンスのもとで実施されるシステム監査の実施
データセンター部門(DC)
データマネージャー
- 特定臨床研究、臨床試験及び医師主導治験のデータマネジメント業務(プロトコル作成支援、eCRF作成支援、データベース構築等)
- 特定臨床研究、臨床試験及び医師主導治験における症例報告書の評価項目及び調査項目のチェック
- 試験進捗報告書の作成
- 中央モニタリングの実施
- 疾患レジストリ研究におけるデータベース構築及び評価項目のチェック
生物統計家
- 臨床試験及び医師主導治験の臨床試験デザイン(必要症例数の設計、割付表の作成)
- 研究計画書の統計的事項の作成
- 統計解析項目とCRFの整合性チェック
- 統計解析計画書(SAP)の作成
- 統計解析の実施・報告書作成
- 学術論文の統計的事項の作成
- 医学統計セミナーの実施
治験管理部門(TM)
CRC
企業治験及び医師主導治験のCRC業務(抜粋)
- 被験者に対する同意説明補助
- 被験者のケア・相談業務
- 被験者に対する治験薬の服薬指導
- 被験者の来院日程等のスケジュール管理
- 血液検査等の検査を行う上での担当部署とのスケジュール調整
- DNA検査等の外部機関での検査が必要な検体の搬送
- 申請前の事前ヒアリングへの参加
- 治験実施前のスタートアップミーティングの実施・準備
- モニタリング及び監査への立会い
- 治験スケジュール管理
- 症例報告書作成の補助
- 治験審査委員会への立会い
臨床研究教育・管理部門(CLM)
臨床研究審査委員会・倫理審査委員会事務局
- 事務室との役割分担の上、委員会の運営を行う。(申請書類の事前レビュー、法・指針への適合性確認、研究者・審査委員の相談対応等)
臨床研究教育事務局
- 英語論文のネイティブチェックを行う(英文エディタ)。
- 教育・研修の企画、運営、受講管理を行う。
CRP
- 当院における臨床研究の実施体制の整備を行う。
- 病院長ガバナンスのもとで実施される臨床研究を把握する(病院長の臨床研究ガバナンス支援業務)。
- 倫理審査委員会及び認定臨床研究審査委員会における法・指針等の規制に関する情報提供を行う。
臨床研究支援部門(CS)
PM・臨床研究CRC
- 各教室が計画している臨床研究(観察研究を含む。)及び医師主導治験のコンセプトを議論するとともに、研究実施に向けたアドバイスを行う(臨床研究支援会議)。
- 臨床研究(観察研究を含む。)の研究計画書等の審査委員会申請支援を行う。
- 研究相談の窓口業務を行うとともに、内容を精査し、各担当部門との調整を行う。
- 研究計画書・同意説明文書のフォーマット作成等の研究実施に係る文書作成を行う。
- 受託した臨床研究・特定臨床研究の事務局支援を担当するとともに、分担施設からの質問等に応対する。また、試験の運営に関するハンドリングを行う。
モニタリング
- 研究者が実施するモニタリングを支援する。(モニタリング手順書の作成支援、モニタリング実施の支援 )
- モニタリングのセミナーを実施する。
- 依頼があったモニタリング業務を行う。(モニタリング手順書の作成、施設訪問モニタリングの実施)
事務室
- 臨床研究センターの運営管理
- 研究支援依頼の窓口業務
- 臨床研究法下で実施する臨床研究の不適合に関する相談・通報の窓口業務
- 倫理審査委員会、認定臨床研究審査委員会、治験審査委員会における事務局業務